Um sabão biológico para deixar também a natureza mais limpa
Redação do Site Inovação Tecnológica – 15/07/2021
A equipe já está trabalhando para adaptar o processo de síntese dos ananatosídeos para a indústria.
[Imagem: Maude Cloutier et al. – 10.1039/D1SC01146D]
Biossurfactantes
Químicos canadenses anunciaram a descoberta de uma substância que promete nada menos do que tornar os sabões mais “limpos” – em termos ambientais.
Maude Cloutier e seus colegas criaram um biossurfactante – um surfactante é o principal ingrediente ativo de sabões, sabonetes, detergentes e xampus.
Enquanto os surfactantes usados pela indústria são derivados do petróleo, o biossurfactante é sintetizado por bactérias, o que o torna um produto facilmente degradável.
Alguns dos biossurfactantes mais seguros para os seres humanos – e com melhor biodegradabilidade – são baseados em moléculas chamadas ramnolipídios. Mas há um problema: Essas substâncias são feitas pela Pseudomonas aeruginosa, uma bactéria patogênica prejudicial ao homem.
“Se quisermos obter todos os benefícios dos ramnolipídeos, precisamos cultivar essas bactérias patogênicas em grande escala. E, como isso é um risco para a saúde, a indústria está procurando alternativas,” explicou o professor Charles Gauthier.
A equipe encontrou substâncias similares aos ramnolipídeos na Pantoea ananatis, uma bactéria não patogênica, e então desenvolveu uma técnica para sintetizar quimicamente essas moléculas, que foram batizadas de ananatosídeos.
A indústria já está demonstrando interesse por esses novos biossurfactantes porque o processo de síntese é simples e passível de ser escalonado para fabricação em escala industrial.
Em preparação para essa tradução do laboratório para a indústria, a equipe já está trabalhando para tornar a substância mais estável.
Bibliografia:
Artigo: Total synthesis, isolation, surfactant properties, and biological evaluation of ananatosides and related macrodilactone-containing rhamnolipids
Autores: Maude Cloutier, Marie-Joëlle Prévost, Serge Lavoie, Thomas Feroldi, Marianne Piochon, Marie-Christine Groleau, Jean Legault, Sandra Villaume, Jérôme Crouzet, Stéphan Dorey, Mayri Alejandra Dìaz De Rienzo, Eric Déziel, Charles Gauthier
Revista: Chemical Science
DOI: 10.1039/D1SC01146D
Eletroquímica
Michael Faraday
Michael Faraday foi um dos maiores cientistas do seu tempo e ainda é um um dos cientistas mais influentes de todos os tempos. Suas descobertas tiveram grande impacto sobre o entendimento do mundo natural.
Michael Faraday (1791-1867)
Faraday descobriu o Carbono e o Cloro e contribuiu para os campos do diamagnetismo, eletrólise, eletroquímica e indução eletromagnética. Ele foi em grande parte autodidata, pois teve que abandonar a escola no quarto ano.
Os dispositivos eletromagnéticos do cientista britânico formam a espinha dorsal da tecnologia de motores elétricos. Ele também publicou artigos sobre o isolamento de benzeno, condensação de gases e enganos ópticos.
As suas contribuições mais importantes e seus trabalhos mais conhecidos tratam dos fenômenos da eletricidade, da eletroquímica e do magnetismo, mas Faraday fez também diversas outras contribuições muito importantes na física e na química.
Faraday foi principalmente um experimentalista, tendo sido descrito como o “melhor experimentalista na história da ciência”, mesmo não conhecendo matemática avançada, como cálculo infinitesimal.
As descobertas de Faraday
As descobertas de Faraday cobrem áreas significativas das modernas física e química. Suas descobertas em eletromagnetismo forneceram a base para os trabalhos de engenharia no fim do século XIX para que Edison, Siemens, Tesla e Westinghouse tornassem possível a eletrificação das sociedades industrializadas. Seus trabalhos em eletroquímica são amplamente usados em química industrial.

Na física, foi um dos primeiros a estudar as relações entre eletricidade e magnetismo. Em 1821, logo após Oersted descobrir que a eletricidade e o magnetismo eram associados entre si, Faraday publicou um trabalho que chamou de “rotação eletromagnética“, elaborando os princípios de funcionamento do motor elétrico.
Em 1831, Faraday descobriu a indução eletromagnética, o princípio por trás do gerador elétrico e do transformador elétrico. Suas ideias sobre os campos elétricos e os magnéticos, e a natureza dos campos em geral, inspiraram trabalhos posteriores fundamentais nessa área, como as equações de Maxwell. Seus estudos sobre campos eletromagnéticos são conceitos-chave da física atual.
Na química também teve grande importância. Descobriu o benzeno, produziu os primeiros cloretos de carbono conhecidos (C2Cl6 e C2Cl4) e ajudou a expandir os fundamentos da metalurgia e da metalografia. As suas experiências garantiram o sucesso na liquefação de gases nunca antes liquefeitos (dióxido de carbono e cloro, entre outros). Isso tornou possíveis novos métodos de refrigeração cujos princípios continuam a ser utilizados nos modernos refrigeradores domésticos.
Talvez a sua maior contribuição tenha sido virtualmente fundar a eletroquímica. Faraday criou termos como eletrólito, ânodo, catodo, eletrodo, e íon.
A Eletroquímica é a parte da Química que estuda a produção de corrente elétrica por meio de reações químicas (pilhas e baterias) e o processo inverso a esse (eletrólise).https://audio.audima.co/iframe-thin-local.html?skin=thin&statistic=true
A Eletroquímica é um dos ramos da Físico-Química que estuda as relações existentes entre reações químicas e a corrente elétrica.
As reações estudadas na eletroquímica são as de oxidorredução, ou seja, aquelas em que há transferência de elétrons, além de ocorrer, de modo simultâneo, uma oxidação e uma redução de determinadas espécies químicas que participam do processo.
O estudo da eletroquímica pode ser dividido em duas partes: pilhas e baterias, e eletrólise.
- Pilhas e baterias:
São dispositivos em que ocorre uma reação de oxidorredução que produz corrente elétrica. Isso significa que há uma conversão de energia química em energia elétrica. Esse processo é espontâneo, pois há a transferência de elétrons entre um metal que tem a tendência de doar elétrons (eletrodo negativo – ânodo), por meio de um fio condutor, para um metal que tem a tendência de receber elétrons (eletrodo positivo – cátodo).
A diferença entre as pilhas e as baterias está no fato de que as pilhas possuem apenas um eletrólito e dois eletrodos, enquanto as baterias são formadas por conjuntos de pilhas em série ou em paralelo.
As pilhas ou baterias primárias são aquelas que não podem ser recarregadas. A reação de oxidorredução delas continua por determinado período, fornecendo energia ao sistema até que essa reação química se esgote e o dispositivo pare de funcionar. Um exemplo é a pilha seca de Leclanché ou pilha ácida usada em equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.
Já as pilhas ou baterias secundárias são recarregáveis e podem ser utilizadas inúmeras vezes. Um exemplo é a bateria usada em automóveis (baterias chumbo/óxido de chumbo ou chumbo/ácido), que é recarregada quando se fornece uma corrente elétrica contínua, aplicando-se uma diferença de potencial para inverter os polos e mudar o sentido da reação química, fazendo assim com que a bateria funcione e regenere grande parte do ácido sulfúrico.Não pare agora… Tem mais depois da publicidade ;)https://ddab119da0fb762c0ff9d7157e8c19cb.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html

As baterias dos automóveis são baterias de chumbo, que geram normalmente 12 volts
- Eletrólise:
A eletrólise é o processo inverso das pilhas e baterias, isto é, uma corrente elétrica gera uma reação química de oxidorredução. A eletrólise é um processo não espontâneo que transforma energia elétrica em energia química.
Existem dois tipos de eletrólises:
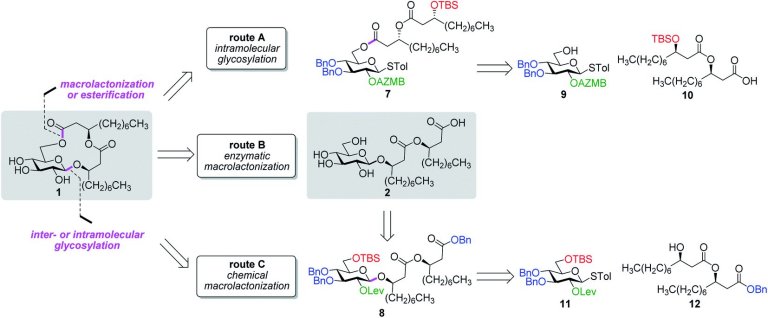
* Eletrólise ígnea: é feita com ausência de água. A corrente elétrica passa pela substância iônica na fase líquida (fundida). Um exemplo é a eletrólise do cloreto de sódio (sal de cozinha) fundido, que produz o gás cloro e o sódio metálico.
Eletrólise ígnea do cloreto de sódio (sal de cozinha)
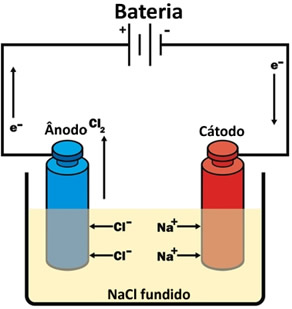
* Eletrólise em meio aquoso: nesse caso temos íons fornecidos pela substância dissolvida na água. Um exemplo da utilização da eletrólise é no revestimento de peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
No exemplo abaixo, temos a cobreação de uma chave, ou seja, por meio da eletrólise de uma solução aquosa de sulfato de cobre, a chave será revestida de cobre:
Esquema de cobreação de uma chave
Aproveite para conferir nossa videoaula sobre o assunto:
Evolução das Espécies e Seleção
O princípio da evolução postula que as espécies que habitaram e habitam o nosso planeta não foram criadas independentemente, mas descendem umas das outras, ou seja, estão ligadas por laços evolutivos. Esta transformação, denominada evolução das espécies, foi apresentada e explicada satisfatoriamente por Charles Darwin, no seu tratado A origem das espécies, em 1859.
A base da evolução biológica é a existência da variedade, ou seja, as diferenças individuais entre os organismos de uma mesma espécie. Na grande maioria das vezes, os indivíduos produzem uma grande quantidade de descendentes, dos quais apenas uma parte sobrevive até a fase adulta. Assim, por exemplo, a cada ano, o salmão põe milhares de ovos, uma ave produz vários filhotes,. No entanto, as populações das espécies em um ecossistema em equilíbrio não crescem indiscriminadamente. Isto significa que os indivíduos são selecionados na natureza, de acordo com suas características. Frequentemente menos de 10 % da prole sobrevive. Os indivíduos que apresentarem características vantajosas para a sua sobrevivência, como por exemplo, maior capacidade de conseguir alimento, maior eficiência reprodutiva, maior agilidade na fuga de predadores, têm maior chance de sobreviver até a idade reprodutiva, na qual irá passar estas características individuais vantajosas à prole. Isto ocorre porque todas as características estão imprensas nos genes do indivíduo. Este é o princípio da seleção natural de Darwin.
Darwin mostrou que a seleção natural tende a modificar as características dos indivíduos ao longo das gerações, podendo gerar o aparecimento de novas espécies.
A partir desta teoria pode-se estudar sob o aspecto evolutivo todo o parentesco entre os seres vivos da Terra, o que culminou em uma árvore genealógica da vida. Nela, os organismos unicelulares semelhantes às bactérias foram os primeiros seres vivos, surgidos a 3 bilhões de anos nos mares primitivos.
Toda a informação genética dos seres vivos está registrada no DNA, a proteína que constitui os genes e cromossomos. Durante o processo de reprodução, a replicação destes genes sofre alterações denominadas mutações genéticas. Quando as mutações começaram a ocorrem nos primeiros seres vivos do planeta, iniciou-se o processo de evolução, através do aparecimento das citadas variações individuais na mesma espécie. A evolução é então impulsionada pelo fenômeno da seleção natural, através das centenas de milênios do tempo geológico.
A história da evolução da vida está documentada através do registro dos fósseis encontrados pelos arqueólogos e evolucionistas.
A pressão gerada pelo ambiente sobre os seres vivos representa uma das principais causas da evolução. Ambientes naturais geralmente apresentam fatores negativos e limitantes, além de realidades difíceis como a predação e a competição. Ambientes hostis e instáveis impulsionam o processo evolutivo, uma vez que selecionam fortemente apenas a sobrevivência dos mais aptos.
Como consequência da pressão ambiental e da existência das mutações genéticas, a vida evoluiu e se especializou, criando toda esta gama de diferentes biomas e ecossistemas que constituem a biosfera. Só o grupo dos animais conta atualmente com mais de 1 milhão de espécies descritas. No topo da linha evolutiva, encontram-se os animais mais complexos e elaborados, os vertebrados, representando apenas 5 % do total.
Coparaativo entre As Teorias evolutivas
Várias teorias evolutivas surgiram, destacando-se , entre elas, as teorias de Lamarck e de Darwin. Atualmente, foi formulada a Teoria sintética da evolução, também denominada Neodarwinismo, que incorpora os conceitos modernos da genética ás ideias essenciais de Darwin sobre seleção natural.
A teoria de Lamarck
Jean-Baptiste Lamarck ( 1744-1829 ), naturalista francês, foi o primeiro cientista a propor uma teoria sistemática da evolução. Sua teoria foi publicada em 1809, em um livro denominado Filosofia zoológica.
Segundo Lamarck, o principio evolutivo estaria baseado em duas Leis fundamentais:
- Lei do uso ou desuso: o uso de determinadas partes do corpo do organismo faz com que estas se desenvolvam, e o desuso faz com que se atrofiem.
- Lei da transmissão dos caracteres adquiridos : alterações provocadas em determinadas características do organismo, pelo uso e desuso, são transmitidas aos descendentes.
Lamarck utilizou vários exemplos para explicar sua teoria. Segundo ele, as aves aquáticas tornaram-se pernaltas devido ao esforço que faziam no sentido de esticar as pernas para evitarem molhar as penas durante a locomoção na água. A cada geração, esse esforço produzia aves com pernas mais altas, que transmitiam essa característica à geração seguinte. Após várias gerações, teriam sido originadas as atuais aves pernaltas.
A teoria de Lamarck não é aceita atualmente, pois suas ideias apresentam um erro básico: as características adquiridas não são hereditárias.
Verificou-se que as alterações em células somáticas dos indivíduos não alteram as informações genéticas contida nas células germinativas, não sendo, dessa forma, hereditárias.
A teoria de Darwin
Charles Darwin ( 1809-1882 ), naturalista inglês, desenvolveu uma teoria evolutiva que é a base da moderna teoria sintética: a teoria da seleção natural. Segundo Darwin, os organismos mais bem adaptados ao meio têm maiores chances de sobrevivência do que os menos adaptados, deixando um número maior de descendentes. Os organismos mais bem adaptados são, portanto, selecionados para aquele ambiente.
Os princípios básicos das ideias de Darwin podem ser resumidos no seguinte modo:
- Os indivíduos de uma mesma espécie apresentam variações em todos os caracteres, não sendo, portanto, indenticos entre si.
- Todo organismo tem grande capacidade de reprodução, produzindo muitos descendentes. Entretanto, apenas alguns dos descendentes chegam à idade adulta.
- O número de indivíduos de uma espécie é mantido mais ou menos constante ao longo das gerações.
- Assim, há grande “luta” pela vida entre os descendentes, pois apesar de nascerem muitos indivíduos poucos atingem a maturalidade, o que mantém constante o número de indivíduos na espécie.
- Na “luta” pela vida, organismos com variações favoráveis ás condições do ambiente onde vivem têm maiores chances de sobreviver, quando comparados aos organismos com variações menos favoráveis.
- Os organismos com essas variações vantajosas têm maiores chances de deixar descendentes. Como há transmissão de caracteres de pais para filhos, estes apresentam essas variações vantajosas.
- Assim , ao longo das gerações, a atuação da seleção natural sobre os indivíduos mantém ou melhora o grau de adaptação destes ao meio.

A teoria sintética da evolução
A Teoria sintética da evolução ou Neodarwinismo foi formulada por vários pesquisadores durante anos de estudos, tomando como essência as noções de Darwin sobre a seleção natural e incorporando noções atuais de genética. A mais importante contribuição individual da Genética, extraída dos trabalhos de Mendel, substituiu o conceito antigo de herança através da mistura de sangue pelo conceito de herança através de partículas: os genes.
A teoria sintética considera, conforme Darwin já havia feito, a população como unidade evolutiva. A população pode ser definida como grupamento de indivíduos de uma mesma espécie que ocorrem em uma mesma área geográfica, em um mesmo intervalo de tempo.
Para melhor compreender esta definição , é importante conhecer o conceito biológico de espécie: agrupamento de populações naturais, real ou potencialmente intercruzantes e reprodutivamente isolados de outros grupos de organismos.
Quando, nesta definição, se diz potencialmente intercruzantes, significa que uma espécie pode ter populações que não cruzem naturalmente por estarem geograficamente separadas. Entretanto, colocadas artificialmente em contato, haverá cruzamento entre os indivíduos, com descendentes férteis. Por isso, são potencialmente intercruzantes.
A definição biológica de espécie só é valida para organismos com reprodução sexuada, já que, no caso dos organismos com reprodução sexuada, já que, no caso dos organismos com reprodução assexuada, as semelhanças entre características morfológicas é que definem os agrupamentos em espécies.
Observando as diferentes populações de indivíduos com reprodução sexuada, pode-se notar que não existe um indivíduo igual ao outro. Execeções a essa regra poderiam ser os gêmeos univitelínicos, mas mesmo eles não são absolutamente idênticos, apesar de o patrimônio genético inicial ser o mesmo. Isso porque podem ocorrer alterações somáticas devidas á ação do meio.
A enorme diversidade de fenótipos em uma população é indicadora da variabilidade genética dessa população, podendo-se notar que esta é geralmente muito ampla.
A compeensão da variabilidade genética e fenotípica dos indivíduos de uma população é fundamental para o estudo dos fenômenos evolutivos, uma vez que a evolução é, na realidade, a transformação estatística de populações ao longo do tempo, ou ainda, alterações na frequência dos genes dessa população. Os fatores que determinam alterações na frequência dos genes são denominados fatores evolutivos. Cada população apresenta um conjunto gênico, que sujeito a fatores evolutivos , pode ser alterado. O conjunto gênico de uma população é o conjunto de todos os genes presentes nessa população. Assim , quanto maior é a variabilidade genética.
Os fatores evolutivos que atuam sobre o conjunto gênico da população podem ser reunidos duas categorias
Fatores que tendem a aumentar a variabilidade genética da população: mutação gênica, mutação cromossônica , recombinação;
Fatores que atuam sobre a variabilidade genética jás estabelecida : seleção natural, migração e oscilação genética.
A integração desses fatores associada ao isolamento geográfico pode levar, ao longo do tempo, ao desenvolvimento de mecanismos de isolamento reprodutivo, quando, então, surgem novas espécies. Nos capítulos seguintes , esses tópicos serão abordados com maiores detalhes.
PRINCIPAIS EVIDÊNCIAS DA EVOLUÇÃO
VOCÊ ESTÁ AQUI:
- PÁGINA INICIAL
- EVOLUÇÃO
- PRINCIPAIS EVIDÊNCIAS DA EVOLUÇÃO
As principais evidências da evolução são os registros fósseis e as semelhanças anatômicas, fisiológicas, celulares e moleculares entre os seres vivos.https://audio.audima.co/iframe-thin-local.html?skin=thin&statistic=true
Segundo as teorias evolutivas, a vida surgiu no planeta e desde então espécies têm surgido, desaparecido e mudado ao longo do tempo. Diversas evidências sustentam esse fato e a seguir vamos conhecer cada uma delas.
→ Evidência Fóssil
Os fósseis são restos ou vestígios de organismos preservados que possuem mais de 10 mil anos e fornecem importantes informações a respeito da vida nos tempos pretéritos e como era o ambiente em determinada época. Ossos, marcas de dentes, pegadas e fezes petrificadas são exemplos de fósseis.
Os fósseis são considerados evidências da evolução porque, por meio deles, é possível observar as características de seres vivos que hoje não mais compõem a fauna e a flora do planeta. Analisando o conjunto de organismos fósseis, é possível ver que o planeta em que vivemos hoje é completamente diferente biologicamente do planeta de 65 milhões de anos atrás. Assim sendo, eles comprovam que a vida surgiu e modificou-se através do tempo.
→ Evidências anatômicas e fisiológicas
Algumas espécies apresentam características anatômicas que muito se assemelham com aquelas presentes em indivíduos de outras espécies. Apesar de muitas vezes essas estruturas não apresentarem a mesma função, é possível inferir que, em algum momento, essas espécies possuíram um ancestral comum.
Quando uma determinada espécie possui órgãos que se desenvolvem de maneira semelhante à de outra, dizemos que elas possuem órgãos homólogos. Esses órgãos podem ou não apresentar a mesma função. Como exemplo, podemos citar o braço de um ser humano e a asa de um morcego.Não pare agora… Tem mais depois da publicidade 😉
Outras vezes, no entanto, os órgãos possuem a mesma função, mas pela análise da anatomia, é possível verificar que a origem embrionária é diferente. Nesses casos, dizemos que os órgãos são análogos e surgiram provavelmente como uma forma de adaptação a um determinado ambiente. Como exemplo, podemos citar as asas das borboletas e dos pássaros.
Os órgãos vestigiais, que podem ser definidos como estruturas atrofiadas que possuem uma função pouco expressiva, também são considerados uma evidência da evolução. Provavelmente, esses órgãos eram importantes nos ancestrais de determinada espécie e, com a evolução, eles se tornaram pouco funcionais e regrediram. Como exemplo de órgãos vestigiais, podemos citar o apêndice nos humanos.
→ Evidências celulares e moleculares
A análise das células e a bioquímica dos organismos têm revelado que existe muita semelhança entre todos os seres vivos. Esse fato sugere que, em algum ponto da história evolutiva, tivemos um ancestral comum.
Quando analisamos as células, é possível perceber que as espécies são bastante semelhantes entre si. A semelhança também é grande entre o código genético, uma vez que o DNA e o RNA possuem apenas quatro bases diferentes. Essas bases são as responsáveis pelas características de todos os seres vivos existentes no planeta.
Percebe-se, portanto, que a teoria da evolução é sustentada por diversos pilares e cada dia é mais evidente que os seres vivos sofrem mudanças através do tempo.
Aproveite para conferir as nossas videoaulas sobre o assunto:

Por Vanessa Sardinha dos Santos
ASSISTA ÀS NOSSAS VIDEOAULAS:
Vídeo 1
Função Orgânica dos Hidrocarbonetos
- Home
- Química Orgânica
- Grupos Funcionais
- Hidrocarbonetos
- Função Orgânica dos Hidrocarbonetos
A função dos hidrocarbonetos engloba todos os compostos orgânicos que possuem suas moléculas formadas apenas por carbono e hidrogênio.https://audio.audima.co/iframe-thin-local.html?skin=thin&statistic=true
Os hidrocarbonetos, como o próprio nome indica, são compostos formados somente por átomos dos elementos carbono e hidrogênio, sendo que a sua fórmula geral é dada por CXHY.
Os hidrocarbonetos podem se subdividir em: alcanos, alcenos, alcinos, alcadienos, cíclicos e aromáticos. Vejamos cada um deles:
- Alcanos ou parafinas:
- Definição: são hidrocarbonetos de cadeia aberta saturados, ou seja, possuem somente ligações simples entre os carbonos.
- Exemplos:
CH4: metano
H3C — CH3: etano
H3C — CH2 — CH3: propano
H3C — CH2 — CH2 — CH3: butano
Observação: Todo hidrocarboneto termina com o sufixo “o”. O que diferencia um hidrocarboneto do outro é o infixo, que indica o tipo de ligação. No caso dos alcanos, o infixo é “an”.
- Fórmula Geral: CnH2n + 2 (em que n = qualquer número inteiro).
Exemplos:
CH4: n = 1
H3C — CH3: C2H6: n = 2
H3C — CH2 — CH3: C3H8: n = 3
H3C — CH2 — CH2 — CH3: C4H10: n = 4
- Fontes e aplicações: A parafina utilizada na fabricação de velas é uma mistura de alcanos de massa molecular elevada, isso também se dá com o petróleo e seus derivados, tais como gasolina e óleo diesel. Assim, os alcanos são importantes como combustíveis e também como matéria-prima na produção de plásticos, tintas, fibras sintéticas, borrachas, entre outros.

As parafinas das velas contêm alcanos
- Alcenos, alquenos ou olefinas:
- Definição: são hidrocarbonetos de cadeia aberta que possuem somente uma ligação dupla entre carbonos.
- Exemplos:
H2C = CH2: eteno
H2C = CH— CH3: propeno
H3C — CH? CH— CH3: but-2-eno
O infixo “en” identifica a ligação dupla dos alcenos.
- Fórmula Geral: CnH2n (em que n = qualquer número inteiro).
Exemplos:
H2C = CH2: C2H4→ n = 2
H2C = CH— CH3: C3H6→ n = 3
H3C — CH= CH— CH3: C4H8→ n = 4
- Fontes e aplicações: O alceno mais comum presente na natureza é o eteno (etileno), o gás responsável pelo amadurecimento das frutas. É raro encontrar um alceno na natureza, sendo produzidos geralmente pelo refino do petróleo.

O etileno é o gás que faz as frutas amadurecerem
- Alcinos ou alquinos:
- Definição: são hidrocarbonetos de cadeia aberta que possuem tripla ligação entre carbonos.
- Exemplos:
.jpg)
O infixo “in” identifica a ligação tripla dos alcinos.
- Fórmula Geral: CnH2n-2 (em que n = qualquer número inteiro).
Exemplos:
.jpg)
- Fontes e aplicações: O alcino mais importante é o etino (acetileno), que apesar de não ser encontrado na natureza, pode ser facilmente produzido por meio de matérias-primas abundantes: carvão, calcário e água. Ele é usado como combustível de maçaricos de oxiacetileno.Não pare agora… Tem mais depois da publicidade 😉

O acetileno é usado em maçaricos de oxiacetileno
- Alcadienos ou dienos:
- Definição: são hidrocarbonetos de cadeia aberta que possuem duas duplas ligações entre carbonos.
- Exemplos:
H2C = HC — CH = CH2: But-1,3-dieno
H3C — H2C — CH = C = CH2: Pent-1,2-dieno
O infixo “dien” identifica as duas duplas ligações dos alcadienos.
- Fórmula Geral: CnH2n-2 (em que n = qualquer número inteiro).
Exemplos:
H2C = HC — CH = CH2: C4H6→ n = 4
H3C — H2C — CH = C = CH2: C5H8→ n = 5
- Fontes e aplicações: Os alcadienos mais importantes são os terpenos derivados do isopreno, encontrados em óleos de essências, extraídos de vegetais e frutas, com cheiro agradável. Um exemplo é o betacaroteno, responsável pela cor laranja-avermelhada da cenoura.

O betacaroteno, que dá cor às cenouras, é um alcadieno
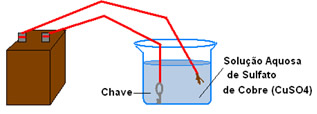
- Hidrocarbonetos cíclicos:
- Definição: são hidrocarbonetos de cadeia fechada. Podem ser cicloalcanos (só possuem ligações simples), cicloalcenos (possuem dupla ligação entre carbonos) e cicloalcinos (com tripla ligação entre carbonos).
- Exemplos:
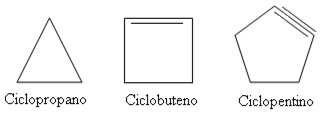
Exemplos de hidrocarbonetos cíclicos
- Fórmula Geral:
– Cicloalcanos: CnH2n
– Cicloalcenos: CnH2n-2
- Fontes e aplicações: Os ciclanos estão presentes no petróleo, o cicloexano é um solvente e removedor de tintas e o ciclopropano é usado em anestesia geral.
O ciclopropano é usado em anestesia geral
- Hidrocarbonetos aromáticos:
- Definição: são hidrocarbonetos que possuem um ou mais anéis benzênicos (núcleos aromáticos), que são representados conforme a figura abaixo:
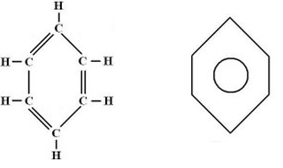
Fórmula estrutural do benzeno e fórmula estrutural simplificada
- Exemplos:
.jpg)
Exemplos de hidrocarbonetos aromáticos
- Fontes e aplicações: O composto mais importante desse grupo é o benzeno, que é encontrado na natureza no alcatrão de hulha, um carvão mineral que resulta da fossilização da madeira. Ele é usado na fabricação de tintas, borrachas, adesivos, detergentes e loções. Seus derivados também são importantes, sendo que um deles, o metilbenzeno (tolueno), é usado na fabricação do explosivo TNT.

Extração de carvão mineral
Por Jennifer Fogaça
Graduada em Química
Forças Intermoleculares
Vídeo-aula

1 de 1
Introdução
Você sabe o que faz com que um material seja sólido, líquido ou gasoso nas condições ambiente?
As fases da matéria são resultado das forças ou interações intermoleculares, também conhecidas como forças de Van der Waals. São elas que irão determinar também as propriedades dos materiais.

Formação de Fases Condensadas
As forças intermoleculares são diferentes das forças primárias (responsáveis pelas formação das ligações entre os átomos).
Forças intermoleculares são forças de atração que ocorrem entre duas ou mais moléculas das substâncias mantendo-as unidas formando um material no estado líquido ou sólido.
As interações intermoleculares são mais fracas que as intramoleculares (interações que ocorrem dentro das moléculas) ou interatômicas (interações que ocorrem entre os átomos). As ligações entre os átomos são consequência das forças intramoleculares, como mostra a Figura 1.
 Figura1: força intramolecular versus força intermolecular.
Figura1: força intramolecular versus força intermolecular.
As forças intermoleculares são responsáveis pelas diferentes fases da matéria, que são o sólido, o líquido e o gasoso (ou vapor). As fases condensadas incluem apenas os estados sólido e líquido. A temperatura na qual ocorre transformação de fase do estado gasoso para o estado líquido ou sólido depende da pressão e da intensidade das forças atrativas entre as moléculas.
Quando uma substância passa do estado sólido para o líquido e depois para o gasoso,as moléculas que compõem essa substância começam a se desorganizar e a se afastar, até que apenas suas ligações intermoleculares sejam rompidas, como mostra a Figura 2.
Para que isso aconteça, é necessário fornecer uma quantidade de energia (geralmente calor) proporcional à intensidade das ligações intermoleculares. É por isso que o éter, por exemplo, evapora em maior quantidade que a água, como mostra a Figura 3.
 Figura 2. Disposição das moléculas em substâncias nas diferentes fases da matéria. Os sólidos possuem maior força intermolecular, e os gases não possuem força intermolecular.
Figura 2. Disposição das moléculas em substâncias nas diferentes fases da matéria. Os sólidos possuem maior força intermolecular, e os gases não possuem força intermolecular.
 Figura 3. O esquema mostra a evaporação da água e do éter. Como, em um mesmo intervalo de tempo, evaporou mais éter que água, as ligações intermoleculares do éter são mais fracas do que as da água.
Figura 3. O esquema mostra a evaporação da água e do éter. Como, em um mesmo intervalo de tempo, evaporou mais éter que água, as ligações intermoleculares do éter são mais fracas do que as da água.
Resumindo, quanto mais fracas forem as ligações intermoleculares, mais volátil será a substância, ou seja, menor será a sua temperatura de fusão e ebulição.
As forças intermoleculares mais importantes são as forças íon-dipolo, dipolo-dipolo, forças de London e as pontes de hidrogênio. A Tabela 1 resume essas interações e compara suas energias com a energia da ligação iônica (íon-íon).
Tabela 1. Energia das forças interiônicas e intermoleculares.
| Tipo de interação | Energia (kJ/mol) | Espécies que interagem |
| Íon-íon | 250 | Íons |
| Íon-dipolo | 15 | Íons e moléculas polares |
| Dipolo-dipolo | 0,3 – 2 | Moléculas polares |
| Ligações de hidrogênio | 20 | Moléculas que contêm N, O, F |
| London | 2 | Todas as moléculas |
🎓 Você ainda não sabe qual curso fazer? Tire suas dúvidas com o Teste Vocacional Grátis do Quero Bolsa 🎓
Forças Íon-Dipolo
Trata-se da interação entre um íon em água e as cargas parciais da molécula polar de água (dipolo).
Nesta interação, o íon se encontra rodeado pelas moléculas de água. A carga parcial negativa do átomo O da água é atraída pelo cátion e as cargas parciais positivas dos átomos H são repelidas.
Assim, as moléculas de água se aglomeram ao redor do cátion, com os átomos de oxigênio apontados para o interior e os átomos de hidrogênio apontando para o exterior, como mostra a Figura 4 (a).
O contrário acontece para o caso de ânions rodeados pelas moléculas de água. Os átomos de oxigênio da água se voltam para o exterior, pois são repelidos pelo ânion, enquanto que os átomos de hidrogênio se voltam para o interior, como mostra a Figura 4 (b).
 Figura 4. Interações íon-dipolo para o caso de (a) cátion e (b) ânion rodeados pelas moléculas de água.
Figura 4. Interações íon-dipolo para o caso de (a) cátion e (b) ânion rodeados pelas moléculas de água.
Forças Dipolo-Dipolo ou Dipolo Permanente
São forças de atração que mantém moléculas polares unidas. Ocorrem quando o lado parcialmente negativo de uma molécula interage com o lado parcialmente positivo de outra molécula. Como exemplos, temos as moléculas de HCl, HBr, SO2, NH3 etc.
 Figura 5. Interações dipolo-dipolo na molécula de HCl.
Figura 5. Interações dipolo-dipolo na molécula de HCl.
Ligações ou Pontes de Hidrogênio
Trata-se de uma atração intermolecular na qual um átomo de hidrogênio de uma molécula é atraído por um átomo muito eletronegativos de outra molécula, como o flúor, o oxigênio e o nitrogênio.
Como exemplo, temos as moléculas de HF, H2O e NH3. A Figura 6 mostra as formações das pontes de hidrogênio nas moléculas de HF.
 Figura 6. Pontes de hidrogênio para moléculas de HF.
Figura 6. Pontes de hidrogênio para moléculas de HF.
Forças de London ou de Van der Waals ou Forças Dipolo Instantâneo + Dipolo Induzido
As forças de dispersão de London ocorrem em qualquer tipo de molécula e átomo. É o único tipo de interação intermolecular que acontece em moléculas polares. São formadas quando uma molécula com dipolo temporário ou instantâneo torna outra temporariamente polar.
Mas afinal, o que é um dipolo instantâneo? Imagine a distribuição dos elétrons na eletrosfera de uma molécula apolar. Estes elétrons estarão distribuídos uniformemente em toda a eletrosfera na maior parte do tempo.
Porém, em algum momento, pode ocorrer um acúmulo de elétrons em um lado só da molécula, o que acaba provocando um dipolo instantâneo. Este dipolo temporário irá induzir a formação de dipolos nas moléculas vizinhas, por meio da repulsão entre os elétrons. Veja na Figura 7 como isso ocorre. Essa alteração que ocorre na nuvem eletrônica é conhecida como Dispersões de London.
 Figura 7. Formação das forças de London.
Figura 7. Formação das forças de London.
Alguns exemplos de moléculas que apresentam forças de London são H2, O2, F2, Cl2, CO2, CH4, C2H6.
Estequiometria – Massa atômica, molar e molecular
Massa Atômica
A massa de um átomo depende do número de elétrons, prótons e nêutrons que o constituem. O conhecimento da massa atômica é de extrema importância no trabalho laboratorial. Mas os átomos são partículas extremamente pequenas – mesmo o menor grão de poeira que a nossa vista possa detectar contém cerca de 1 x 1016 átomos! Na prática, é impossível pesar um único átomo, porém, podemos determinar experimentalmente a relação de massa entre dois átomos. O primeiro passo é atribuir um valor de massa a um átomo de determinado elemento e considerá-la massa-padrão.
De acordo com uma convenção internacional, massa atômica (às vezes chamada de peso atômico) é a massa de um átomo em unidades de massa atômica (u). Uma unidade de massa atômica é definida como a massa igual a exatamente 1/12 da massa de um átomo de carbono-12. O carbono-12 é o isótopo do carbono constituído por seis prótons e seis nêutrons. Por convenção, estabeleceu-se que a massa atômica do carbono-12 é igual a 12 u, e é o padrão para a medida de massas atômicas de outros elementos. Experimentalmente, verifica-se que, em média, um átomo de hidrogênio contém apenas 8,400% da massa do carbono- 12. Assim, se considerarmos que a massa de um átomo de carbono-12 é igual a exatamente 12 u, a massa do hidrogênio será 0,084 x 12,00 u, ou seja, igual a 1,008 u. Cálculos análogos mostram que as massas atômicas do oxigênio e do ferro são, respectivamente, iguais a 16,00 u e 55,85 u. Embora não tenhamos conhecimento de qual é a massa atômica média do ferro, sabemos que é 56 vezes superior à massa do hidrogênio.
Massa Atômica Média
Ao consultarmos a tabela de massas atômicas, como a que é apresentada logo no início deste livro, verificamos que o valor da massa atômica do carbono é 12,01 u e não 12,00 u (Figura 1). Essa diferença pode ser explicada pelo fato de que a maior parte dos elementos (incluindo o carbono) existentes na natureza possui mais de um isótopo. Por essa razão, quando se determina a massa atômica de um elemento, geralmente indica-se o valor da massa média da mistura natural de seus isótopos. Por exemplo, as abundâncias naturais do carbono-l2 e carbono-13 são, respectivamente. 98,90% e 1,10%. A massa atômica do carbono-13, determinada experimentalmente é 13,00335 u.

Figura 1. Massa atômica média do carbono.
Na verdade, a massa atômica média do carbono pode ser calculada pela expressão:
massa atômica do
carbono natural = (0,9890).(12,00000 u) + (0,0110).(13,00335 u) = 12,01 u
Se fosse possível medir a massa de um único átomo de carbono, o valor encontrado seria 12,00000 u ou 13.00335 u, mas nunca igual a 12,01 u.
As massas atômicas de muitos elementos têm sido determinadas com exatidão até cinco ou seis algarismos significativos. Contudo, utilizaremos aqui massas atômicas com quatro algarismos significativos.
Número de Avogadro e Massa Molar de um Elemento
As unidades de massa atômica fornecem uma escala relativa para as massas dos elementos. Os átomos possuem massas muito pequenas e não existe balança que permita pesá-los diretamente em unidades de massa atômica. Como em situações concretas trabalhamos com amostras macroscópicas constituídas por enorme número de átomos, é conveniente utilizar uma unidade especial que possibilite descrevê-los. A idéia de usar uma unidade para representar um grande número de objetos não é nova. Por exemplo, um par (dois itens), uma dúzia (12 itens) e uma grosa (144 itens) são unidades familiares. Para os químicos, os átomos e moléculas são medidos em mols.
No sistema SI,o mol a quantidade de substância que contém tantas entidades elementares (átomos, moléculas ou outras partículas) quantas existem em, exatamente 12 g (ou 0,012 kg) do isótopo carbono-12. O número de átomos existente em 12 g de carbono-12 foi determinado experimentalmente e denomina-se número de Avogadro (NA). em honra ao cientista italiano Amedeo Avogadro. O valor, atualmente aceito, para esse número é:
NA = 6.0221367 x 1023
Geralmente, arredondamos o número de Avogadro para 6,022 x1023. Dessa forma. 1
mol de átomos de hidrogênio contém 6,022 x 1023 átomos de hidrogênio, assim como
uma dúzia de laranjas contém 12 laranjas. A Figura 2 apresenta amostras contendo 1
mol de vários elementos comuns.

Figura 2. Um mol de cada um dos seguintes elementos comuns: carbono (carvão em pó), enxofre (pó amarelo), ferro (pregos), cobre (fios) e mercúrio (metal líquido prateado).
Vimos que 1 mol de átomos de carbono-12 tem massa igual a exatamente 12 g e contém 6,022 x 1023 átomos. Essa massa do carbono-12 denomina-se massa molar (M), a qual é definida como a massa (em gramas ou quilogramas) de 1 mol de unidades (tais como átomos ou moléculas) de uma substância. Observe que a massa molar do carbono-12 (em gramas) é numericamente igual à sua massa atômica expressa em u. Do mesmo modo, a massa atômica do sódio (Na) é 22,99 u e a sua massa molar é 22,99 g; a massa atômica do fósforo é 30,97 u e a sua massa molar é 30.97 g e assim por diante. Se soubermos a massa atômica de um elemento, saberemos também a sua massa molar.
Usando a massa atômica e a massa molar, podemos calcular a massa em gramas de um único átomo de carbono-12. Para tanto, precisamos fazer as conversões corretas entre massas atômica, massa molar e o número de Avogadro. Tais conversões podem facilmente serem realizadas seguindo um modelo descrito na Figura 3:

Figura 3. Relação entre massa (m em gramas) de um elemento e seu número de mols (n), e entre o número de mols de um elemento e seu número de átomos (N). M representa a massa molar (g/mol) no elemento e NA o número de Avogadro.
Massa molecular
Se conhecermos as massas atômicas dos átomos constituintes de uma molécula, podemos calcular a massa dessa molécula. A massa molecular (às vezes chamada de peso molecular) é a soma das massas atômicas (em u) dos átomos da molécula. Por exemplo, a massa molecular da água (H2O) é:
2.(massa atômica do H) + massa atômica do O
2.(1,008 u ) + 16,00 u = 18,02 u
Temos de multiplicar a massa atômica de cada elemento pelo número de átomos desse elemento presente na molécula e, depois, somar as contribuições de todos os elementos.
Conhecendo a massa molecular, podemos determinar a massa molar de uma molécula ou composto. A massa molar (em gramas) é numericamente igual à massa molecular (em u). Por exemplo, a massa molecular da água é 18,02 u, logo a sua massa molar é 18,02 g. Note que 1 mol de água pesa 18,02 g e contém 6,022 x 1023 moléculas de H2O, tal como 1 mol de carbono elementar contém 6,022 x 1023 átomos de carbono.
Uma vez que substâncias iônicas existem como redes tridimensionais de íons, não é apropriado falar de moléculas de NaCl, por exemplo. Em vez disso, falamos de fórmula unitária, representada pela fórmula química da substância. A fórmula unitária do NaCl compõe-se de um íon Na+ e um íon Cl–. Portanto, a massa molecular do NaCl é a massa de uma fórmula unitária:
MNaCl= 23,0 u + 35,5 u = 58,5 u
Referências:
BROWN, T.L., LEMAY, H. E., BURSTEN, B. E. – Química, A Ciência Central, 9ª Edição; São Paulo : Pearson Prentice Hall, 2005.
CHANG, Raymond – Química Geral – Conceitos Essenciais, 4 ed. ; São Paulo : McGraw-Hill, 2006
