Eletroquímica
Michael Faraday
Michael Faraday foi um dos maiores cientistas do seu tempo e ainda é um um dos cientistas mais influentes de todos os tempos. Suas descobertas tiveram grande impacto sobre o entendimento do mundo natural.
Michael Faraday (1791-1867)
Faraday descobriu o Carbono e o Cloro e contribuiu para os campos do diamagnetismo, eletrólise, eletroquímica e indução eletromagnética. Ele foi em grande parte autodidata, pois teve que abandonar a escola no quarto ano.
Os dispositivos eletromagnéticos do cientista britânico formam a espinha dorsal da tecnologia de motores elétricos. Ele também publicou artigos sobre o isolamento de benzeno, condensação de gases e enganos ópticos.
As suas contribuições mais importantes e seus trabalhos mais conhecidos tratam dos fenômenos da eletricidade, da eletroquímica e do magnetismo, mas Faraday fez também diversas outras contribuições muito importantes na física e na química.
Faraday foi principalmente um experimentalista, tendo sido descrito como o “melhor experimentalista na história da ciência”, mesmo não conhecendo matemática avançada, como cálculo infinitesimal.
As descobertas de Faraday
As descobertas de Faraday cobrem áreas significativas das modernas física e química. Suas descobertas em eletromagnetismo forneceram a base para os trabalhos de engenharia no fim do século XIX para que Edison, Siemens, Tesla e Westinghouse tornassem possível a eletrificação das sociedades industrializadas. Seus trabalhos em eletroquímica são amplamente usados em química industrial.

Na física, foi um dos primeiros a estudar as relações entre eletricidade e magnetismo. Em 1821, logo após Oersted descobrir que a eletricidade e o magnetismo eram associados entre si, Faraday publicou um trabalho que chamou de “rotação eletromagnética“, elaborando os princípios de funcionamento do motor elétrico.
Em 1831, Faraday descobriu a indução eletromagnética, o princípio por trás do gerador elétrico e do transformador elétrico. Suas ideias sobre os campos elétricos e os magnéticos, e a natureza dos campos em geral, inspiraram trabalhos posteriores fundamentais nessa área, como as equações de Maxwell. Seus estudos sobre campos eletromagnéticos são conceitos-chave da física atual.
Na química também teve grande importância. Descobriu o benzeno, produziu os primeiros cloretos de carbono conhecidos (C2Cl6 e C2Cl4) e ajudou a expandir os fundamentos da metalurgia e da metalografia. As suas experiências garantiram o sucesso na liquefação de gases nunca antes liquefeitos (dióxido de carbono e cloro, entre outros). Isso tornou possíveis novos métodos de refrigeração cujos princípios continuam a ser utilizados nos modernos refrigeradores domésticos.
Talvez a sua maior contribuição tenha sido virtualmente fundar a eletroquímica. Faraday criou termos como eletrólito, ânodo, catodo, eletrodo, e íon.
A Eletroquímica é a parte da Química que estuda a produção de corrente elétrica por meio de reações químicas (pilhas e baterias) e o processo inverso a esse (eletrólise).https://audio.audima.co/iframe-thin-local.html?skin=thin&statistic=true
A Eletroquímica é um dos ramos da Físico-Química que estuda as relações existentes entre reações químicas e a corrente elétrica.
As reações estudadas na eletroquímica são as de oxidorredução, ou seja, aquelas em que há transferência de elétrons, além de ocorrer, de modo simultâneo, uma oxidação e uma redução de determinadas espécies químicas que participam do processo.
O estudo da eletroquímica pode ser dividido em duas partes: pilhas e baterias, e eletrólise.
- Pilhas e baterias:
São dispositivos em que ocorre uma reação de oxidorredução que produz corrente elétrica. Isso significa que há uma conversão de energia química em energia elétrica. Esse processo é espontâneo, pois há a transferência de elétrons entre um metal que tem a tendência de doar elétrons (eletrodo negativo – ânodo), por meio de um fio condutor, para um metal que tem a tendência de receber elétrons (eletrodo positivo – cátodo).
A diferença entre as pilhas e as baterias está no fato de que as pilhas possuem apenas um eletrólito e dois eletrodos, enquanto as baterias são formadas por conjuntos de pilhas em série ou em paralelo.
As pilhas ou baterias primárias são aquelas que não podem ser recarregadas. A reação de oxidorredução delas continua por determinado período, fornecendo energia ao sistema até que essa reação química se esgote e o dispositivo pare de funcionar. Um exemplo é a pilha seca de Leclanché ou pilha ácida usada em equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.
Já as pilhas ou baterias secundárias são recarregáveis e podem ser utilizadas inúmeras vezes. Um exemplo é a bateria usada em automóveis (baterias chumbo/óxido de chumbo ou chumbo/ácido), que é recarregada quando se fornece uma corrente elétrica contínua, aplicando-se uma diferença de potencial para inverter os polos e mudar o sentido da reação química, fazendo assim com que a bateria funcione e regenere grande parte do ácido sulfúrico.Não pare agora… Tem mais depois da publicidade ;)https://ddab119da0fb762c0ff9d7157e8c19cb.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html

As baterias dos automóveis são baterias de chumbo, que geram normalmente 12 volts
- Eletrólise:
A eletrólise é o processo inverso das pilhas e baterias, isto é, uma corrente elétrica gera uma reação química de oxidorredução. A eletrólise é um processo não espontâneo que transforma energia elétrica em energia química.
Existem dois tipos de eletrólises:
* Eletrólise ígnea: é feita com ausência de água. A corrente elétrica passa pela substância iônica na fase líquida (fundida). Um exemplo é a eletrólise do cloreto de sódio (sal de cozinha) fundido, que produz o gás cloro e o sódio metálico.
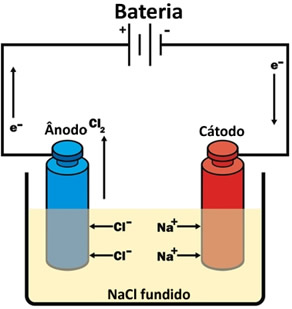
Eletrólise ígnea do cloreto de sódio (sal de cozinha)
* Eletrólise em meio aquoso: nesse caso temos íons fornecidos pela substância dissolvida na água. Um exemplo da utilização da eletrólise é no revestimento de peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
No exemplo abaixo, temos a cobreação de uma chave, ou seja, por meio da eletrólise de uma solução aquosa de sulfato de cobre, a chave será revestida de cobre:
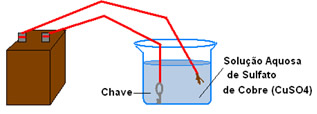
Esquema de cobreação de uma chave
Aproveite para conferir nossa videoaula sobre o assunto:
Publicado em 15/10/2020, em Conceitos Químicos. Adicione o link aos favoritos. Deixe um comentário.

Deixe um comentário
Comentários 1